Artículo publicado originalmente por Brenda Valderrama en la columna "Reivindicando a Plutón" del Son de Cuernavaca el 23 de noviembre de 2015.
Dicen que la pereza es la madre de la inventiva. ¿Y qué
podría dar más pereza que estar drenando agua helada desde el fondo de una mina
de carbón por horas? Bueno, seguramente muchas otras cosas más pero hoy vamos a
hablar de un invento de esos que surgen de la necesidad y que transformaron a la humanidad: la máquina de
vapor.
El carbón se ha utilizado en toda la historia de la
humanidad para generar calor, ya sea para hacer más confortables las
habitaciones o simplemente para cocinar. Durante el siglo XVI Inglaterra
comenzó a explotar de manera sistemática sus depósitos de carbón y comenzó,
también, a desarrollar la tecnología que le permitiera hacerlo de manera más
eficiente. A partir del uso de
instrumentos sencillos que agilizan y reducen el esfuerzo humano o de animales
de carga como son las palancas, las poleas y la rueda misma, se explotaron
también otras fuentes naturales como por ejemplo el viento o las corrientes de
agua. Sin embargo, el verdadero cambio provino cuando se aprovechó la capacidad
calórica del carbón para realizar trabajo.
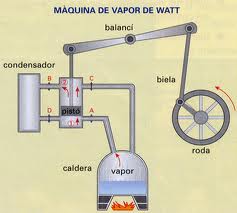
Después de una serie de experimentos preliminares, Thomas
Newcomen diseña en 1712 un instrumento que aprovechaba la capacidad motriz del
vapor de agua para subir un pistón. Algo parecido a lo que sucede con la
válvula de una olla de presión en casa donde el chorro de vapor puede empujar
el tapón hacia arriba. La novedad de Newcomen fue asociar una palanca al pistón
y el movimiento de la palanca a una bomba de agua que demostró podía drenar
tanta agua del fondo de la mina como lo harían dos bombas tradicionales tiradas
por caballos.
Las ventajas fueron evidentes ya con un solo operario se
reemplazaban dos tiros de caballo. Además, las bombas no se cansan como los
caballos, tampoco hay que darles de comer y todavía mejor, el sistema se
alimenta con el mismo carbón que se extrae de la mina. Como se imaginarán, la
bomba fue un éxito y se comenzó a utilizar no solo en minas de carbón sino en cualquier
otro sitio que necesitara un drenaje constante de agua por lo que fue
optimizada y profesionalizada.
Cincuenta años más tarde, James Watt, un joven ingeniero que
trabajaba en la Universidad de Glasgow en Escocia, se dio cuenta que una parte
importante de la energía emitida por el carbón no se aprovechaba para mover el
pistón sino que se disipaba en forma de calor. Con un cambio de diseño mejoró
la eficiencia del motor reduciendo a solo 25% la cantidad de carbón que se
necesitaba y también la de agua ya que añadió un sistema de reciclado. Emocionado
por sus descubrimientos, Watt siguió trabajando en el diseño de una versión de
bomba todavía más eficiente y por lo tanto, más pequeña, la cual lanzó al
mercado diez años después todavía como una maquinaria dedicada a la minería.
Como buen emprendedor y no contento con su éxito, Watt
siguió trabajando en su diseño y lo modificó de tal forma que la palanca
conectada al pistón pudiera desarrollar otros tipos de movimientos que fueron
aprovechados por diferentes empresas como la textil detonando la revolución
industrial. A partir de ese momento ya no hubo marcha atrás, la sociedad se
volvió dependiente de la energía contenida primero en el carbón y después en el
petróleo.
James Watt fue un hombre práctico y aunque desarrolló
conceptos útiles como el de “caballos de fuerza” se requirió de la
participación de otros científicos para entender, dimensionar y generalizar sus
observaciones dando sustento a una rama de la física moderna conocida como
Termodinámica.
Inicialmente, la termodinámica se aplicó al estudio de la
interacción entre calor y trabajo y también de su relación con variables medibles
como son el volumen, la presión y la temperatura. En su desarrollo posterior,
la termodinámica se ha ampliado para el estudio de cualquier fenómeno de
transferencia de energía incluyendo reacciones químicas.
Del trabajo de cientos de científicos se han logrado
desarrollar dos conceptos claves que se conocen como las Leyes de la
Termodinámica. La Primera Ley nos dice que la energía puede cambiar de forma
pero no puede ser creada ni destruida. Es decir, que la energía del Universo es
constante desde su origen y seguirá siendo así por siempre. Usemos el ejemplo
de la máquina de vapor donde la energía contenida en el carbón se libera como
calor durante la combustión. La bomba de Watt lo que hizo fue canalizar parte
de esa energía para realizar trabajo. Ese trabajo puede transformarse a su vez
a otras formas de generación de energía, como por ejemplo eléctrica. Sin embargo,
no importa cuántas ni que tan complejas sean las transformaciones, la cantidad
de energía siempre será igual al 100% original, ni más ni menos.
En reconocimiento a sus aportaciones al desarrollo
científico y tecnológico, la comunidad científica decidió usar el apellido de
James Watt para nombrar la unidad del sistema métrico decimal relacionada con
la potencia. Es decir, un watt es una unidad que nos refleja la capacidad de un
sistema de generar trabajo a partir de la transformación de energía. Piensa en
eso la próxima vez que cambies un foco.